Objetivo:
El objetivo de esta experiencia es extraer proteínas de algunas sustancias para luego reconocer su naturaleza proteica. Para esto utilizaremos los ensayos de Biuret y Xantoprotíico y ciertas muestras de leche, gelatina, clara de huevo, aspartano y suero de leche.
fundamento teórico
Reacción xantoproteica
La reacción xantoproteica es un método que se puede utilizar para determinar la presencia de proteínas solubles en una solución, empleando ácido nítrico concentrado. La prueba da resultado positivo en aquellas proteínas con aminoácidos portadores de grupos aromáticos, especialmente en presencia de tirosina. Si una vez realizada la prueba se neutraliza con un álcali, se torna color amarillo oscuro.
La reacción xantoproteica se puede considerar como una sustitución electrofílica aromática de los residuos de tirosina de las proteínas por el ácido nítrico dando un compuesto coloreado amarillo a pH ácido.
Según las guías químicas es una reacción cualitativa, mas no cuantitativa( esto se debe al hecho de que nos permite determinar si la muestra es una proteína soluble en agua, pero no aporta información relevante para cálculos estequiométricos). Por ende determina la presencia o no de proteínas. Para cuantificar se usa otra reacción, como la de Biuret, y se hace un análisis espectro fotométrico.
Biuret
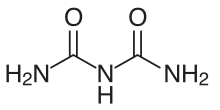
Fórmula química del Biuret
El Reactivo de Biuret es aquel que detecta la presencia de proteínas, péptidos cortos y otros compuestos con dos o más enlaces peptídicos en sustancias de composición desconocida.
Está hecho de hidróxido potásico (KOH) y sulfato cúprico (CuSO4), junto con tartrato de sodio y potasio (KNaC4H4O6·4H2O). El reactivo, de color azul, cambia a violeta en presencia de proteínas, y vira a rosa cuando se combina con polipéptidos de cadena corta. El hidróxido de potasio no participa en la reacción, pero proporciona el medio alcalino necesario para que tenga lugar.
Materiales Reactivos utilizados
Vaso de Bohemia Leche descremada en polvo
Papel de filtro CuSO4 al 1%
Gradilla Ácido nítrico concentrado
Soporte Edulcorante
Tela metálica Acido etanoico 2.0M
Mechero NaOH al 10%
Tubo de ensayo Gelatina
Termómetro Clara de huevo
Varilla de vidrio Agua
Vaso de Bohemia Leche descremada en polvo
Papel de filtro CuSO4 al 1%
Gradilla Ácido nítrico concentrado
Soporte Edulcorante
Tela metálica Acido etanoico 2.0M
Mechero NaOH al 10%
Tubo de ensayo Gelatina
Termómetro Clara de huevo
Varilla de vidrio Agua
Procedimiento
Para determinar la presencia -o no
presencia- de proteínas o péptidos de cadena corta mediante el empleo de el
reactivo de Biuret este es el procedimiento a seguir:
Se toma un tubo de ensayo y se
colocan tres centímetros cúbicos de la muestra (Caseína, gelatina, ovo albumina, etc.)
Se añaden 2 centímetros cúbicos de
solución de hidróxido de sodio (NaOH) al 20%.
Más adelante se agregan 4 o 5 gotas
de solución de sulfato cúprico(CuSO4) diluida al 1%.(En nuestro caso utilizamos
10 g CuSO4 y 3 gotas de NaOH(ac) al 1% de concentración.)
Posteriormente analizamos los
resultados.
Para determinar la presencia de
proteínas solubles en solución acuosa tomamos un tubo de ensayo con la muestra.
Le agregamos 10g de HNO3(ac) concentrado (ácido nítrico). Analizamos los
resultados, en función de si la solución se tornó de color amarillo o no.
Muestra Biuret Xantoprotéico
-Caseina +
-Gelatina + -
-Ovoalumina + -
-Aspartano - -
-Glicina - -
-Proteinas - +
de suero de
leche
CASEÍNA:
Es una proteína de carácter ácido debido a su elevada proporción de aminoácidos ácidos (pH=4,6).
La caseína humana es más rica en cistina y glúcidos que la vaca lo que la hace más apropiada para el bebé.
Biuret de caseína - El color de ésta es violeta, por lo tanto podemos decir que la caseina es un polipépeptido -existen
por lo menos dos enlaces peptídicos.
Reacciona
con las bases formando caseinatos utilizados en la industria para la
fabricación de colas y adhesivos. También se utiliza en la industria
textil.
La
caseína precipita por acción de los ácidos. Esto puede ocurrir a través
de las formulación de ácido láctico por la acción bacteriana sobre la
lactosa o mediante el agregado de un ácido hasta alcanzar el pH
correspondiente a su punto isoeléctrico. La precipitación puede
producirse por la acción enzimática de la quimiotripsina.
PROCEDIMIENTO
1) Coloque aproximiadamente 25 ml de leche descremada en un vaso de Bohemia
2) Caliente hasta aproximadamente 40ºC agitando con la varilla de vidrio.
3) Adicione ácido etanoico 2,0M (gota a gota) agitando en forma continua hasta coagulación total.
4) Separe el cuágulo de caceína del suero mediante floración.
5) Seque cuidadosamente la caceína con la ayuda del papel de filtro.
6) Separe dos porciones del solido obtenido de aproximadamente 1 cm3 y colóquelas en dos tubos de ensayo.
Xantoprotéica de caseína - Luego del ensayo xantoprotéico la producción de un producto coloreado Amarillo es una prueba de la presencia de tirosina o triptófano en la caseína.
GELATINA:
La
gelatina es una proteína compleja, es decir, un polímero compuesto
por aminoácidos. Como sucede con los polisacáridos, el grado de
polimerización, la naturaleza de los monómeros y la secuencia en la
cadena proteica determinan sus propiedades generales. Una notable
propiedad de las disoluciónes de esta molécula es su comportamiento
frente a temperaturas diferentes: son líquidas en agua caliente y se
solidifican en agua fría.
Al
ser proteína en estado puro, ésa es su mayor propiedad nutritiva:
proteína (84-90%), sales minerales (1-2%) y agua (el resto). La gelatina
se utiliza en la fabricación de alimentos para el enriquecimiento
proteínico, para la reducción de hidratos de carbono y como sustancia
portadora de vitaminas.
PROCEDIMIENTO
1) Preparar gelatina
2) Colocarla en dos tubos de ensayo
3) Realizar las reacciones ya mencionadas
Biuret de Gelatina - Luego
del ensayo de biuret la muestra se torna color violeta por tanto,
estamos en presencia de por lo menos dos enlaces peptídicos.
Xantoprotéica de Gelatina - Una vez realizado el ensayo Xantoproteico la muestra resulta incolora por ende, da negativa y deducimos que la gelatina no presenta tirosina o triptófano.
OVOALBÚMINA:
Las proteínas
de la clara de huevo entran dentro de la definición de glicoproteínas,
que son proteínas que llevan enlazados contenidos diversos de glúcidos a
la cadena de aminoácidos. Entre éstas, la más abundante es la
ovalbúmina, que es una fosfoglicoproteína.
La ovalbúmina es la principal proteína de la clara del huevo y la que le da sus propiedades características (junto con la otra albúmina no fosforada).
La ovalbumina es, pues, una fosfoglicoproteína de 385 restos de aminoácido con un peso
molecular aproximado de unos 42.7 KDa. Es una proteína de referencia en bioquímica y es conocida a la industria alimentaria por sus propiedades como transportadora, estabilizadora y formadora de emulsiones. Se desnaturaliza por calor a los 78ºC (temperatura de semidesnaturalización) perdiendo su estructura replegada de albúmina y produciendo un gel con gran retención de agua.
La ovalbúmina es la principal proteína de la clara del huevo y la que le da sus propiedades características (junto con la otra albúmina no fosforada).
La ovalbumina es, pues, una fosfoglicoproteína de 385 restos de aminoácido con un peso
molecular aproximado de unos 42.7 KDa. Es una proteína de referencia en bioquímica y es conocida a la industria alimentaria por sus propiedades como transportadora, estabilizadora y formadora de emulsiones. Se desnaturaliza por calor a los 78ºC (temperatura de semidesnaturalización) perdiendo su estructura replegada de albúmina y produciendo un gel con gran retención de agua.
PROCEDIMIENTO
1) Romper un huevo
2) Separar la clara de la yema
3) Remover la clara y colocarla en agua
4) Colocar parte de la solución en dos tubos de ensayo
5) Realizar las dos reacciones mencionadas
Biuret de Ovoalbúmina - Después
de esta ensayo, la solución se torna color violeta por lo tanto se
puede deducir que la ovoalbúmina presenta por lo menos dos o más enlaces
peptidicos.
Xantoprotéica de Ovoalbúmina - Luego
de este ensayo, la solución se torna color amarillo por ende esto nos
indica la presencia de tirosina o triptófano en la ovoalbúmina.
ASPARTAMO:
El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.
El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.
PROCEDIMIENTO
1) Tomar una punta de espátula de edulcorante y colocarla en dos tubos de ensayo.
2) Agregar un poco de agua en cada uno de los tubos.
3) Realizar las reacciones mencionadas anteriormente.
Biuret del Aspartano - la
solución no resulta de color violeta por lo tanto, la reacción da
negativa y deducimos que el aspartamo no presenta enlaces peptidicos.
Xantoprotéica del Aspartano - la solucion resulta incolora por ende, la reaccion da negativa y deducimos que el aspartamo no presenta tirosina o triptófano.
GLICINA:
La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. Su fórmula química es NH2CH2COOH y su masa es 75,07. La glicina es un aminoácido no esencial.
Biuret de la Glicina - Luego
de realizado el ensayo, la solución resulta incolora por lo tanto, la reacción
da negativa y deducimos que el aspartamo no presenta enlaces peptidicos.
La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. Su fórmula química es NH2CH2COOH y su masa es 75,07. La glicina es un aminoácido no esencial.
PROCEDIMIENTO
1) Colocar una punta de espátula en un tubo de ensayo
2) Agregar un poco de agua
3) Realizar las reacciones mencionadas previamente
Xantoprotéica de la Glicina - Una
vez realizado el ensayo, la solución resulta incolora por ende, la
reacción da negativa y deducimos que el aspartamo no presenta tirosina o
triptófano.
PROTEINAS DE SUERO DE LA LECHE:
El suero de leche es un líquido obtenido en el proceso de fabricación del queso y de la caseína,
después de la separación de la cuajada o fase micelar. Sus
características corresponden a un líquido fluido, de color verdoso
amarillento, turbio, de sabor fresco, débilmente dulce, de carácter
ácido, con un contenido de nutrientes o extracto seco del 5,5% al 7%
provenientes de la leche.
Biuret de suero de leche - la solución no resulta color violeta por lo tanto podemos deducir que no presenta enlaces peptídicos.
Xantoprotéica de suero de leche - la solución resulta de color amarillo por lo tanto podemos deducir que presenta tirosina y triptófano.
Los errores que pueden estar asociados con esta práctica son de medición, ya que a lo largo de la experiencia las mediciones fueron realizadas con poca precisión debido a que empleamos instrumentos como el cuenta gotas para volúmenes que implican un margen de error considerable en las mediciones.
No hay comentarios:
Publicar un comentario